神经发育性疾病,尤其是自闭症,是儿童期最常见的疾病之一,然而迄今为止仍然没有有效的治疗方法。几十年的科学研究揭示了自闭症具有极强的遗传基础,并且已经确认数百个基因的突变可能导致自闭症。然而,至今我们对自闭症的病因机制仍然了解有限。
在我们的大脑皮层中,抑制性γ-氨基丁酸能中间神经元(简称抑制性神经元)是除兴奋性神经元之外的另一类重要神经元。它们在胚胎发育中后期腹侧端脑产生,然后迁移到背侧端脑,可以通过释放神经递质γ-氨基丁酸,避免兴奋性神经元的过度激活。两类神经元共同组成了神经网络中的兴奋-抑制平衡,一旦平衡被打破,则可能与神经系统疾病产生关联。 
图片来源:123RF
此前的研究已经在自闭症患者的大脑标本中,发现了抑制性神经元数量和形态的变化。这引发了科学家对抑制性神经元受损是否是自闭症的一个关键病因的猜测。然而,在已知与自闭症相关的数百个基因中,确定哪些与抑制性神经元的发育相关,以及它们如何调控这一过程一直是一个巨大的挑战。
其中的一个难点在于,人类的抑制性神经元发育延续到出生后的一两年。这种延长的抑制性神经元发育被认为有助于提高人类大脑的认知能力,但常作为实验模型的啮齿类动物却不具备这样的发育过程,因此科学家们需要寻找模拟人类抑制性神经元发育的全新手段。
在一项最新发表于《自然》杂志的研究中,斯坦福大学Sergiu Pașca教授领导的团队结合人类端脑组装体与CRISPR筛选技术,揭示了致病基因在人类抑制性神经元发育中的作用,并为理解神经发育性疾病的机制、寻找治疗方案奠定了基础。Pașca实验室博士后孟祥玲为论文第一作者。
“在神经科学研究中,研究人员很少有机会利用功能完整的人类脑组织进行实验,因此我们对于神经系统功能和神经疾病机制的大部分了解都来自动物模型,这长期以来一直限制了我们寻找有效治疗人类疾病的药物,” 孟祥玲博士介绍道,“然而,由人诱导的人类全能干细胞分化出的类脑器官和端脑组装体为我们提供了具有一定功能的人类脑组织,解决了长期以来无法使用人类神经细胞研究人类神经系统疾病的问题。结合CRISPR筛选技术,研究人员能够同时研究数百甚至更多致病基因的功能,从而全面了解疾病的治病机理,为深入探索疾病机制提供了新的途径。”
为了模拟人类抑制性神经元的发育过程,孟祥玲博士将诱导的人类全能干细胞诱导分化成类似腹侧端脑细胞的三维结构,形成腹侧端脑类器官。这些腹侧端脑类器官可以与背侧端脑类器官融合成端脑组装体,模拟抑制性神经元从腹侧端脑迁移到背侧端脑的过程。通过结合CRISPR筛选技术,研究团队揭示了与神经发育性疾病相关的425个基因在抑制性神经元发育中的作用。

▲对神经发育性疾病相关基因的CRISPR筛选揭示了调控人类抑制性神经元生成与迁移的基因(图片来源:参考资料[1])
具体来说,他们在第一项筛选实验中发现13个基因对抑制性神经元的生成有影响,其中包括CSDE1和SMAD4。这两个基因的敲除会阻碍腹侧端脑的细胞分化过程。 在第二项筛选实验中,研究者利用1000多个端脑组装体筛选发现33个基因影响抑制性神经元迁移到背侧端脑的过程。其中一个名为LNPK的基因引起了特别关注。进一步研究表明,敲除LNPK后,抑制性神经元从腹侧端脑迁移到背侧端脑的数量显著减少,并且它们的迁移速度也减慢。
LNPK编码一种稳定内质网结构的蛋白质——Lunapark,而内质网在抑制性神经元迁移过程中的作用一直鲜有研究。通过荧光标记内质网,孟祥玲博士及合作者揭示了在抑制性神经元迁移时,内质网首先沿着移动方向迁移,然后才是细胞核的迁移。然而,在LNPK敲除的细胞中,这种内质网迁移现象显著减少,伴随的是抑制性神经元每次迁移的距离缩短。
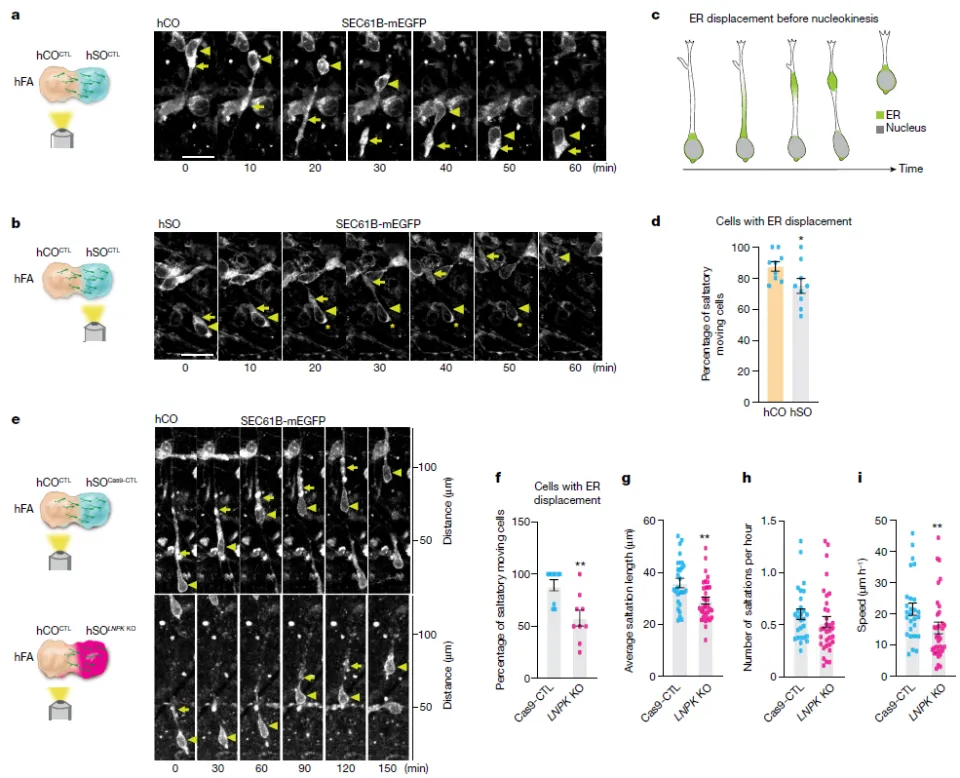
▲LNPK的敲除抑制了内质网迁移现象(图片来源:参考资料[1])
Pasca教授团队的工作不仅强调了内质网和Lunapark在抑制性神经元迁移中的重要作用,同时也证明了通过将人类端脑组装体与CRISPR筛选技术相结合,我们可以同时研究数百甚至更多致病基因在特定大脑发育时期的作用。这项研究为自闭症等神经发育性疾病的治疗和预防提供了有力的理论基础。
「特此声明:本网站中的所有文章均由自闭症(孤独症)专家、医生、康复机构、特教老师、自闭症孩子的家长原创或其他网站转载,如需转载请联系客服或注明出处。如果这些文章有侵犯你的权益,请联系我们删除。」